一般背景
与MDD法规相比,欧盟MDR法规包括一些新内容以及制造商必须履行的义务。值得一提的是,安全性和临床性能摘要(SSCP)是制造商根据欧盟MDR法规第32条,针对植入装置和III类医疗器械起草的重要文档。MDCG 2019-9修订版1指南文档中详细描述了SSCP的内容、准备流程以及上传流程,包括模板。
SSCP是一份公开文档,等EUDAMED数据库完全投用后,将存储在此数据库中。文档名称已经暗示了其内容,现将其概述如下。
欧盟MDR法规规定的PMCF活动的关键步骤如下:
SSCP文档所需章节
- 器械和制造商标识,包括基本唯一器械标识(Basic UDI-DI)和唯一注册码(SRN)(如已发布)
- 器械预期用途以及适应症和禁忌症、目标群体
- 器械描述,包括引用前代产品或型号(如有)信息、区别描述以及与此器械搭配使用的相关附件、其他器械和产品的描述
- 剩余风险、不良副作用、警告以及预防措施信息
- 根据附录XIV及上市后临床跟踪相关信息制定的临床评估摘要
- 可能的诊断或治疗方案
- 建议的用户资料和培训
- 引用适用的统一标准和通用规范
- 修订历史
在结合上述有关所需内容和预期目标群体的信息时,SSCP的特定目标可能更加明显(下图,左侧)。相反,SSCP不应被视为其他文档(即使是专业医疗咨询文档),如下图,右。
医疗器械安全性和临床性能摘要(SSCP)文档的合理目的/用途是什么?
预期用途
用于…
- 使目标群体能够公开访问关于器械的现有及更新信息,包括:
- 预期用途、功能等
- 器械的安全指导方针
- 现场安全纠正措施(FSCA)、现场安全通知(FSN)
- 器械的临床表现
- 患者的临床疗效
- 目标群体如下:
- 医疗专业人士
- 作为间接最终用户或直接用户的患者(如适用
- 最终提高透明度并提供合适的信息获取途径
非预期用途
不得用于…
- 就特定的用户或患者医疗情况提出诊断或治疗的一般意见(治疗建议)或
- 替代使用说明(IFU)作为确保安全使用特定器械的主要文档,或
- 替代植入卡或其他强制性文档上的强制性信息
- 如需要,期待医疗专业人士咨询意见,或
- 用作/理解为营销或销售传单!
SSCP的不同之处
由于SSCP是符合性评估流程的组成部分,建议在起草文档前先仔细查看相关要求。
需要考虑的重要因素如下:
- SSCP是TD(技术文档)的组成部分
- SSCP需由申请初始认证和所有更新的公告机构验证
- SSCP的目标群体是医疗专业人士和/或患者(在某些情况下)
- 除内容外,在起草合规的SSCP时还需要注意格式要求,尤其是面向患者的部分
- SSCP需要始终保持最新状态
用内容“充实”SSCP
在起草SSCP时,无需检索或生成新数据。SSCP内容应全部来源于技术文档,概述如下。因此,在起草SSCP文档前,应确保所有源文档足够完善。在CER、IFU和其他技术文档完成前就起草SSCP文档毫无意义。
SSCP处于“食物链”的末端…
SSCP中的内容应完全取自技术文档,并符合欧盟MDR法规附录II和附录III的要求。
原始文档主要包括 …
- 临床评估报告(CER)
- 使用说明(IFU)
- 风险管理文档(RM)
- 上市后监管文档(PMS/PMCF)
- 技术文档中的其他客观证据(例如设计验证/确认报告 - 提供有关前代产品/产品差异的信息、变更原因等)
如果很难通过这些文档为SSCP提供所需信息,应认识到一点:临床评估报告(CER)或其他文档亟待完善!
SSCP定稿前,请先修订相关文档。
患者部分有什么要求?
对于(a)可植入器械(患者将获得植入卡)和(b)III类器械(由患者直接使用),SSCP中必须编写患者部分(注意:MDR法规附录XVI中列出的器械符合SSCP要求,应始终被视为与患者信息相关)。
格式和语言要求
MDCG指南要求使用通俗语言,以确保非专业人士理解SSCP文档的患者部分。如需验证内容的可读性或提高可理解性,建议执行可读性测试(例如,弗莱施易读性测试),并对具有代表性的目标群体开展调研。如果患者部分使用的语言无法被非专业人士理解,通常由公告机构提出不合规认定意见。
在所需的验证阶段,由公告机构以一种规定语言对SSCP文档草稿版进行评估。制造商应负责将文档翻译为其他语言。其他建议见下文。
SSCP要求 / 公告机构预期要求是什么?
- 技术层面:可打印 / 可搜索文件格式(PDF)
- 布局:选择便于阅读的字体类型和大小,确保文档结构清晰/条理分明(例如设置标题、段落格式)
- 内容:通俗易读,行文简练,表达明晰,客观性强,能够充分总结有利和不利数据
- 语言:患者和非专业人士(患者部分)均能轻松读懂
- SSCP并非市场或销售传单。 参见MDCG 2020-19修订版1。

SSCP是技术文档的组成部分
SSCP文档与其他技术文档紧密相关,如下图所示。SSCP内容与技术文档相应内容保持一致很重要。
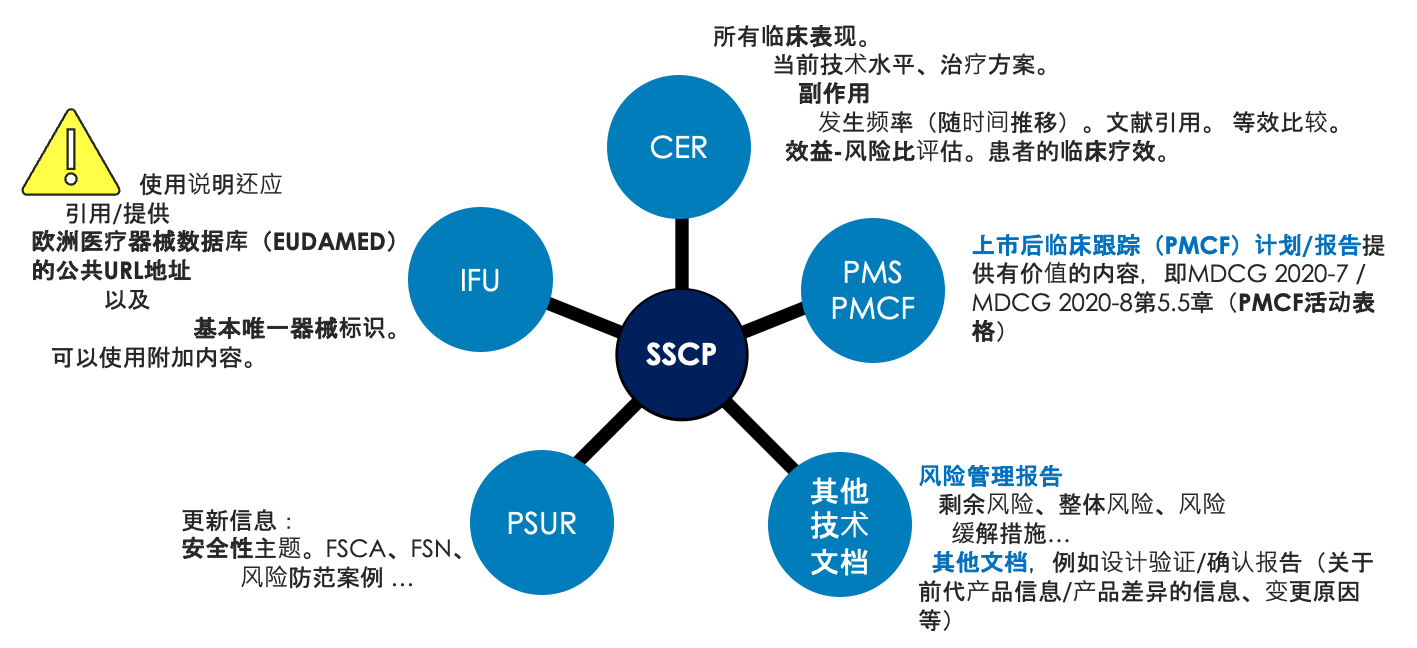
SSCP文档包含2个重要的缩略语:S = 安全性;CP = 临床性能。因此,SSCP文档与RMF(风险管理文件)、CER(临床评估报告)、PMCF(上市后临床跟踪)和PSUR(定期安全性更新报告)紧密相关。
如在器械生命周期中更新这些文档,SSCP文档也需要相应地更新以保持一致性。注意:根据器械的风险等级,可能需由公告机构参与更新流程。至少每年更新一次PSUR和PMCF,以更新SSCP(如需要)。
误区和解决方案
>尽管MDCG 2019-9版本1包含模板和要求详细信息,某些部分仍容易被公告机构发现问题。尤其是第4部分(风险和警告 > 量化和时间的关系)和第5部分(临床评估和上市后临床跟踪摘要 > 临床性能和安全性与当前技术水平总体摘要)。严格遵守MDCG 2019-9修订版1指南列出的要求是成功通过公告机构认证的关键。>
如需支持,AKRA TEAM很高兴为您效劳!
要点
SSCP是符合性评估程序中的重要文档。尽管MDCG指南可用于起草SSCP文档,MDCG 2019-9修订版1在某些方面似乎模棱两可,这可能导致制造商有不同理解,造成输出内容的差异。而这又可能阻碍公告机构的评估,甚至导致文档认证失败。
简而言之:在起草SSCP时要特别注意并考虑的几个主题,如以下所示。
SSCP:怎么做才能满足法规要求?
重要注意事项
针对医疗专业人士和患者分别提供了不同模板。 仔细检查医疗器械是否可以直接用于患者,以及植入卡是否适用于器械。这两种情况下,患者部分均为必填部分。 MDCG 2019-9修订版1建议提供针对医疗专业人士和患者的预先声明。包括SSCP中的相关段落。
一些建议。确保…
原始文档足够完善
遵循模板中提出的编号方式和结构(参见MDCG 2019-9修订版1)
输出文件可搜索且可打印(PDF)
在使用说明中引用SSCP
在患者部分中使用“通俗语言”,避免使用医学术语
解释所有缩略语或使用缩略语列表
使内容与临床评估报告、使用说明保持一致
不包含宣传性质的元素
以结构分明、表达清晰的方式呈现内容
使用针对医疗器械的EMDN代码
我们的服务
起草SSCP文档之前,向我们的专家进行咨询。
差距评估 / SSCP草稿的准备度检查,包括详细改进建议。
就公告机构提出的不合规认定意见 / 不足进行咨询。在您撰写给公告机构的回复信时提供支持。
符合MDR要求的SSCP模板(包含详细描述)。这将帮助您起草SSCP文档并考虑所需因素。